
Độc tính hệ thống của thuốc gây tê tại chỗ
1. Mở đầu
Độc tính hệ thống của thuốc gây tê tại chỗ (LAST) là một tác dụng phụ đe dọa tính mạng có thể xảy ra sau khi dùng thuốc gây tê cục bộ thông qua nhiều đường khác nhau. Việc tăng cường sử dụng các kỹ thuật gây tê cục bộ trong các quá trình chăm sóc sức khỏe khác nhau làm cho sự hiểu biết hiện đại về LAST ngày càng cao. Dữ liệu gần đây đã chứng minh rằng các cơ chế cơ bản của LAST là đa yếu tố, với các hiệu ứng tế bào đa dạng trong hệ thống thần kinh trung ương và hệ tim mạch. Mặc dù biểu hiện thần kinh là phổ biến nhất, LAST thường biểu hiện không điển hình, và một phần năm các trường hợp được báo cáo có rối loạn tim mạch đơn thuần. Có một số yếu tố rủi ro liên quan đến thuốc được sử dụng và kỹ thuật tiến hành. LAST có thể được giảm thiểu bằng cách nhắm mục tiêu các yếu tố rủi ro có thể thay đổi, bao gồm cả việc sử dụng siêu âm cho các kỹ thuật gây tê khu vực và hạn chế liều lượng thuốc. Đã có những phát triển đáng kể trong sự hiểu biết về điều trị LAST. Những tiến bộ chính bao gồm điều trị sớm bằng liệu pháp nhũ tương lipid, xử trí co giật kịp thời và lựa chọn cẩn thận dược lý hỗ trợ tim mạch. Nhận thức về các cơ chế, các yếu tố rủi ro, phòng ngừa và điều trị LAST là rất quan trọng đối với bất kỳ cá nhân nào sử dụng thuốc gây tê tại chỗ trong thực hành lâm sàng.
2. Giới thiệu
Độc tính hệ thống gây tê tại chỗ (LAST) là một tác dụng phụ đe dọa tính mạng liên quan đến việc sử dụng ngày càng phổ biến các kỹ thuật gây tê cục bộ (LA) trong các cơ sở chăm sóc sức khỏe khác nhau, với tỷ lệ hiện được ước tính là 0,03%. Sự phát triển của các kỹ thuật gây tê vùng, chẳng hạn như phương pháp gây tê bề mặt với khối lượng lớn,1,2, sự liên quan ngày càng tăng của các kỹ thuật ống thông liên tục,3 sử dụng nhiều kỹ thuật gây tê vùng trong cùng một bệnh nhân,4 và sử dụng phương pháp gây mê,5tất cảgóp phần vào những rủi ro của LAST. Sinh lý bệnh cơ bản của LAST và cách điều trị của nó là chủ đề của cuộc điều tra quan trọng trong những năm gần đây, và sự hiểu biết của chúng tôi về những điều này đã phát triển đáng kể. Bài viết này trình bày một quan điểm đương đại về tình trạng hiểu biết hiện tại về LAST, bao gồm các cơ chế, trình bày và điều trị.
3. Cơ chế
Các cơ chế mà LAST tạo ra các biểu hiện lâm sàng của nó có thể được làm rõ từ dược động học của Las.6
3.1. Dược động học của LA
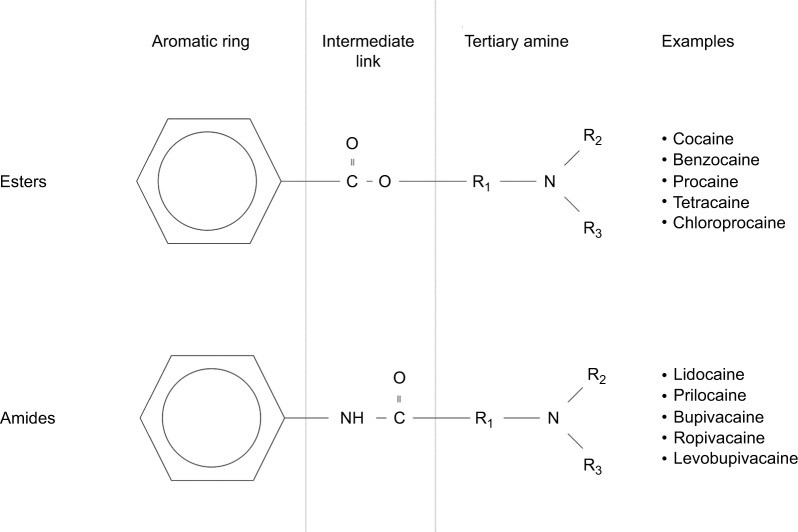
Nồng độ đỉnh trong huyết tương của LA và thời gian đạt được mức đỉnh được chi phối bởi tốc độ hấp thu toàn thân. Điều này được xác định bởi việc cung cấp mạch máu của các vị trí tiêm, cũng như khối lượng lắng đọng thuốc [6,7]. Khi ở trong huyết tương, phân phối LA đến các cơ quan được xác định bằng tưới máu, với các mô được tưới máu tốt như não, tim, gan và phổi nhận phần lớn khối LA ban đầu.8 Trong huyết tương, phần tự do của thuốc quyết định các tác dụng lâm sàng và độc hại và trải qua quá trình trao đổi chất. Mặc dù các LA aminoamide như lidocaine, bupivacaine và ropivacaine có protein liên kết cao với α 1-Cid glycoprotein, liên kết protein của các aminoester LA, bao gồm cả Procaine và chloroprocaine, nhỏ đến mức không quan trọng về mặt lâm sàng ( Hình 1). Aminoamide LA trải qua quá trình chuyển hóa enzyme đầu tiên đáng kể nhờ các enzyme cytochrom P450 (CYP / CYP450) ở gan, với tốc độ thay đổi tùy theo dược lý của thuốc. Các tác nhân Aminoester trải qua quá trình thủy phân nhanh chóng bằng cholinesterase huyết tương, tạo ra các chất chuyển hóa tan trong nước được bài tiết qua nước tiểu [9].
3.2. Cơ chế hoạt động của LA
Các tác nhân LA phát huy tác dụng của chúng bằng cách gắn vào miền nội bào của kênh Na V , do đó ức chế quá trình truyền và khử cực ion thần kinh, và ngăn chặn sự truyền dẫn tế bào thần kinh.10 LA cũng có thể liên kết và chặn các kênh K + , kênh Ca 2+ , kênh Na + K + ATPase, cũng như một số mục tiêu khác [11-15]. Đáng chú ý, LA có thể can thiệp vào tín hiệu tế bào nội bào và màng tế bào [16-19], ảnh hưởng đến quá trình trao đổi chất của cyclic adenosine monophosphate, protein kinase B (Akt) và 5-adeonosine monophosphate protein kinase (AMPK), trong số các kinase kích thích khác [20-22]. LA cũng đã được chứng minh là làm suy yếu quá trình chuyển hóa ty lạp thể, sản xuất adenosine triphosphate, ức chế thụ thể ryanodine ở mạng lưới sarcoplasmic và làm giảm độ nhạy Ca 2+ của myofilaments. Rất nhiều mục tiêu LA ( Hình 2) giải thích bức tranh cơ học và lâm sàng phức tạp của LAST.
3.3. Cơ chế hoạt động của LA
Các tác nhân LA phát huy tác dụng của chúng bằng cách gắn vào miền nội bào của kênh Na V , do đó ức chế quá trình truyền và khử cực ion thần kinh, và ngăn chặn sự truyền dẫn tế bào thần kinh [10]. LA cũng có thể liên kết và chặn các kênh K + , kênh Ca 2+ , kênh Na + mãK + ATPase, cũng như một số mục tiêu khác [11-15]. Đáng chú ý, LA có thể can thiệp vào tín hiệu tế bào nội bào và màng tế bào [16-19], ảnh hưởng đến quá trình trao đổi chất của cyclic adenosine monophosphate, protein kinase B (Akt) và 5-adeonosine monophosphate protein kinase (AMPK), trong số các kinase kích thích khác [20-22]. LA cũng đã được chứng minh là làm suy yếu quá trình chuyển hóa ty lạp thể, sản xuất adenosine triphosphate, ức chế thụ thể ryanodine ở mạng lưới sarcoplasmic và làm giảm độ nhạy Ca 2+ của myofilaments. Rất nhiều mục tiêu LA (Hình 2) giải thích bức tranh cơ học và lâm sàng phức tạp của LAST.
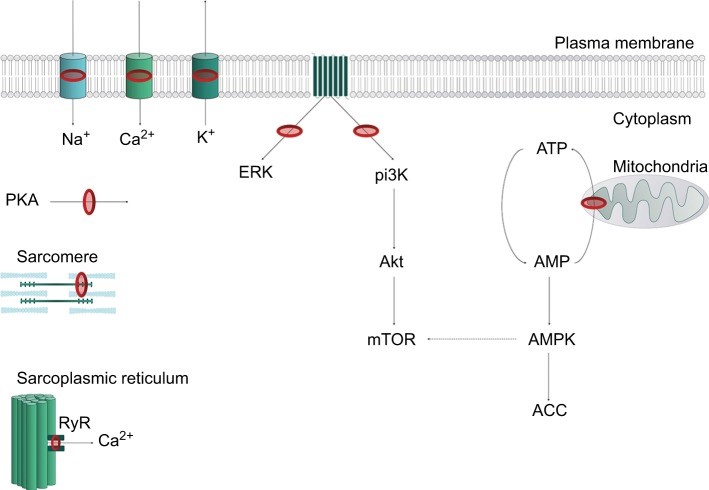
Lưu ý: Trong màng sinh chất, LA chặn kênh Na v (Na + ), kali (K + ) và kênh canxi (Ca 2+ ). Sự ức chế hệ thống truyền tin thứ hai trên các thụ thể kết hợp G-protein xuyên màng metabotropic dẫn đến ức chế ERK và pi3K. Điều này dẫn đến sự rối loạn của các con đường kinase xuôi dòng, bao gồm giảm Akt và do đó, mTOR. Phosphoryl hóa ty thể của AMP thành ATP bị ức chế, dẫn đến sự gia tăng ức chế, kinase AMPK ức chế năng lượng, từ đó làm giảm nhẹ mTOR. Các mục tiêu ức chế khác bao gồm PKA, ức chế co bóp phụ thuộc canxi tại sarcomere và điều chế RyR. Nhẫn đỏ đại diện cho các trang web hành động của LA. Đường chấm chấm đại diện cho hành động ức chế.
Chữ viết tắt: AMP, adenosine monophosphate; ATP, adenosine triphosphate; LA, gây tê cục bộ; RyR, thụ thể ryanodine.
3.4. Độc tính hệ thần kinh trung ương (CNS)
Tăng nồng độ LA trong huyết tương ban đầu làm ảnh hưởng đến con đường ức chế vỏ não bằng cách phong tỏa các kênh NaV , phá vỡ sự khử cực tế bào thần kinh ức chế [23]. Ức chế các con đường này dẫn đến các đặc điểm lâm sàng kích thích của sự thay đổi cảm giác và thị giác, kích hoạt cơ bắp và hoạt động co giật sau đó. Khi nồng độ LA trong huyết tương tăng lên, các con đường kích thích bị ảnh hưởng, tạo ra một giai đoạn trầm cảm của độc tính thần kinh, mất ý thức, hôn mê và ngừng hô hấp.
3.5. Độc tính hệ thống tim mạch (CVS)
Vô số các mục tiêu phân tử LA đã nói ở trên tạo ra các tính năng độc hại phức tạp trong CVS, bao gồm rối loạn dẫn truyền, rối loạn chức năng cơ tim và mất khả năng của trương lực mạch máu ngoại biên. Các hiệu ứng chính có thể phát sinh từ rối loạn nhịp, với các hiệu ứng CVS khác là thứ yếu. Sự dẫn truyền bình thường bị phá vỡ bởi sự phong tỏa kênh natri trực tiếp, chủ yếu là ở bó His. Bằng cách đưa điện thế nghỉ của màng đến mức âm hơn, sự lantruyền điện thế bị suy giảm, dẫn đến các khoảng PR, QRS và ST kéo dài. Tái phát nhịp tim nhanh và rối loạn nhịp tim xảy ra sau đó, có thể trở nên tồi tệ hơn do phong tỏa kênh kali hơn nữa, kéo dài khoảng QT.
Rối loạn chức năng cơ tim có một số cơ chế đóng góp. Kênh canxi và Na + -CA 2+ phong tỏa trao đổi bơm làm giảm dự trữ canxi nội bào và, do đó, làm giảm sự co bóp. Kết quả cuối cùng của sự gián đoạn Akt, AMPK, do đó làm gián đoạn quá trình chuyển hóa glucose nội bào do insulin, cùng với việc giảm dự trữ adenosine triphosphate nội bào, và sản xuất adenosine monophosphate bị suy yếu góp phần làm giảm khả năng co bóp của cơ tim ( Hình 2). Một tác dụng ức chế trực tiếp liên quan đến pH của LA được tác động lên các cơ chế kiểm soát tế bào thần kinh của baroreceptor cũng như tác động tiêu cực đến trương lực mạch máu toàn thân [24].
4. Trình bày
Mặc dù 40% LAST biểu hiện không điển hình độc tính CNS là đặc điểm phổ biến nhất của LAST (68%- 77%), chủ yếu ở dạng động kinh [25-27]. Các biểu hiện ban đầu đa dạng đã được mô tả (mặc dù nhiều khả năng chưa được báo cáo đầy đủ) và có thể bao gồm dị cảm ngoại biên, nhầm lẫn, rối loạn thị giác âm thanh, chứng khó đọc, kích động hoặc giảm mức độ ý thức. Một phần ba các trường hợp được báo cáo về LAST bắt đầu bằng các tính năng CNS tiến triển liên quan đến các dấu hiệu CVS và một phần năm các tập LAST có các rối loạn CVS riêng rẽ [27]. Mặt khác, các đặc điểm đặc trưng của độc tính CVS là rõ ràng, nhưng rối loạn nhịp tim, thiếu hụt dẫn truyền, hạ huyết áp và cuối cùng là ngừng tim có thểnhìn thấy được [28]. LAST xảy ra thường xuyên nhất ngay sau khi tiêm LA và dữ liệu gần đây chứng minh rằng việc xuất hiện chậm trễ có thể xảy ra ở nhiều thời điểm khác nhau cho đến vài ngày sau khi tiêm truyền [29].
5. Yếu tố rủi ro
Các yếu tố rủi ro để phát triển LAST có thể được phân loại thành các yếu tố liên quan đến thuốc được tiêm, bệnh nhân hoặc kỹ thuật.
5.1. Thuốc
Tỷ lệ trụy tim mạch / CNS (CC / CNS) là tỷ lệ liều thuốc cần thiết để gây ra sự sụp đổ tim mạch thảm khốc với liều thuốc cần thiết để gây co giật.26 Một tỷ lệ CC / CNS thấp có liên quan đến nhiều tác nhân gây độc cho tim [30], trong khi LA có tỷ lệ CC / CNS cao hơn có giới hạn an toàn cao hơn. Điều này là do việc xuất hiện sớm hơn các tính năng CNS có thể giúp chẩn đoán sớm hơn (và do đó, điều trị) LAST trước khi đột quỵ tim mạch xảy ra. Ropivacaine và levobupivacaine, ví dụ, có tỷ lệ CC / CNS cao hơn so với bupivacaine; do đó, có vẻ hợp lý khi ưu tiên sử dụng các loại thuốc này khi muốn sử dụng các LA tác dụng dài. Tuy nhiên, Cảnh giác luôn luôn được yêu cầu, vì tất cả các loại thuốc LA có thể gây ra LAST [28,31,32]
LA cũng có tác dụng vận mạch nội tại khác nhau. Levobupivacaine và ropivacaine có đặc tính vận mạch phụ thuộc vào liều có khả năng kéo dài thời gian và hấp thu toàn thân chậm, trái với bupivacaine có đặc tính giãn mạch và có thể dẫn đến hấp thu toàn thân nhanh hơn.
Liều LA thích hợp phải là liều thấp nhất đạt được thời gian và mức độ giảm đau mong muốn hoặc gây mê [25]. Một liều LA nhất định sẽ được kết hợp với sự thay đổi giữa các cá nhân về nồng độ trong huyết tương tùy thuộc vào vị trí và tốc độ tiêm thuốc hoặc đặc điểm riêng của bệnh nhân. Những quan sát như vậy đã đặt câu hỏi cho mỗi kg và liều khuyến cáo tối đa ở người lớn [33], đặc biệt là liều dựa trên trọng lượng tối đa khác nhau giữa các quốc gia và chủng tộc. Tuy nhiên, những điều này phục vụ như một tài liệu tham khảo hữu ích và liều tối đa nên được tuân thủ, đặc biệt là ở những bệnh nhân có trọng lượng cơ thể thấp (Bảng 1).
Bảng 1: Đề nghị dùng thuốc cho các tác nhân gây tê tại chỗ thường được sử dụng
| Gây tê cục bộ | Đơn độc | Với epinephrine | ||
| Liều tối đa | Liều tối đa | Liều tối đa | Liều tối đa | |
| Bupivacaine | 2 mg⋅kg −1 | 175 mg | 3 mg⋅kg −1 | 225 mg |
| Levobupivacaine | 2 mg⋅kg −1 | 200 mg | 3 mg⋅kg −1 | 225 mg |
| Chất gây tê | 5 mg⋅kg −1 | 350 mg | 7 mg⋅kg −1 | 500 mg |
| Mepivacaine | 5 mg⋅kg −1 | 350 mg | 7 mg⋅kg −1 | 500 mg |
| Ropivacaine | 3 mg⋅kg −1 | 200 mg | 3 mg⋅kg −1 | 250 mg |
| Prilocaine | 6 mg⋅kg −1 | 400 mg | 8 mg⋅kg −1 | 600 mg |
Ghi chú: Dữ liệu từ Berde và Strichartz. 92 Dadure C, Sola C, Dalens B, Capdevila X. Gây tê vùng ở trẻ em. Trong: Miller RD (Ed.). Gây mê Miller , lần thứ tám. Philadelphia: Elsevier; 2015: 2718. 93 Học viện Nhi khoa Hoa Kỳ; Học viện Nha khoa Nhi khoa Hoa Kỳ, Côte CJ, Wilson S; Nhóm làm việc về an thần. Hướng dẫn theo dõi và quản lý bệnh nhân nhi trong và sau khi dùng thuốc an thần cho các thủ tục chẩn đoán và điều trị: một bản cập nhật. Nhi khoa 2006; 118: 2587 Từ2602. 94
5.2. Bệnh nhân
5.2.1. Tuổi tác
Bệnh nhân ở độ tuổi giới hạn được chứng minh là có nguy cơ mắc LAST cao nhất. 27 Trẻ sơ sinh và trẻ nhỏ giảm nồng độ trong huyết tương của protein liên kết α 1 -acid glycoprotein và hệ thống enzyme gan chưa trưởng thành có thể làm tăng phần tự do LA trong huyết tương. Do đó, nên giảm 15% ở những bệnh nhân <4 tháng tuổi.
Bệnh nhân cao tuổi đã giảm độ thanh thải LA do giảm tưới máu cơ quan trao đổi chất và chức năng dược lực học, do đó làm tăng khả năng tích lũy thuốc với các mũi tiêm liên tục của LA hoặc truyền liên tục. Bệnh nhân cao tuổi có thể có nhiều bệnh đi kèm và những thay đổi thoái hóa có thể khiến người cao tuổi dễ bị ảnh hưởng hệ thống của LA hơn, mặc dù mức độ gắn kết protein tương đối không thay đổi. Vì cơ xương có thể hoạt động như một bể chứa cho LA, khối lượng cơ xương giảm cũng có liên quan đến việc tăng nguy cơ LAST [27]. Do đó, để đề nghị giảm liều 10% -20% ở những bệnh nhân lớn tuổi [26].
5.2.2. Mang thai
Mang thai làm giảm nồng độ trong huyết tương của glycoprotein α 1 -acid và tăng cung lượng tim. Cùng với nhau, những điều này dẫn đến việc tưới máu nhanh chóng các vị trí tiêm, hấp thu LA nhanh và nồng độ LA tự do đỉnh cao hơn. Ngoài ra, tắc tĩnh mạch ngoài màng cứng có thể làm tăng sự hấp thu thuốc và / hoặc khả năng di chuyển qua các ống thông. Đối với sự kết hợp của các lý do đã nói ở trên, các sản phụ có nguy cơ mắc LAST cao hơn, và do đó, nên giảm liều LA thần kinh ngoại biên và thần kinh trung ương [33]
5.2.3. Bệnh thận
Bệnh nhân mắc bệnh thận nặng không chỉ có tăng cung lượng tuần hoàn và giảm độ thanh thải LA, mà còn tăng nồng độ glycoprotein α 1 -acid. Kết quả là, nồng độ trong huyết tương tự do phần lớn không thay đổi và việc giảm liều thường không cần thiết, trừ khi bệnh nhân mắc bệnh tiểu đường với nhiễm toan chuyển hóa [34,35]
5.2.4. Bệnh tim
Bệnh nhân mắc bệnh tim mạch có nguy cơ mắc LAST. Những người bị rối loạn dẫn truyền trước đó có thể dễ bị nhiễm độc tim mạch và nên sử dụng liều lượng cẩn thận cũng như sử dụng các loại thuốc gây độc cho tim ít hơn như ropivacaine hoặc levobupivacaine.
Bệnh nhân bị rối loạn chức năng timnghiêm trọng đặc biệt dễ bị nhạy cảm và rối loạn nhịp tim do LA gây ra do giảm tưới máu gan và thận dẫn đến giảm chuyển hóa và đào thải, tương ứng. Tưới máu kém đến vị trí tiêm có thể làm giảm nồng độ đỉnh trong huyết tương của LA, nhưng nếu thời gian lưu thông kéo dài, việc phát hiện tiêm LA tĩnh mạch (bằng cách phát hiện một chất đánh dấu như epinephrine) có thể bị trì hoãn. Giảm liều là không cần thiết trong suy tim nhẹ vừa phải, nơi bảo tồn tưới máu mô, nhưng được khuyến cáo trong suy tim nặng [33].
5.2.5. Rối loạn chức năng gan
Rối loạn chức năng gan đơn độc không cần điều chỉnh liều cho các kỹ thuật gây tê khu vực một mũi mặc dù giảm độ thanh thải gan của LA. Một khối lượng lớn hơn của phân phối và duy trì tổng hợp glycoprotein α 1 acid cung cấp một giới hạn an toàn ở những bệnh nhân mắc bệnh gan. Tuy nhiên, ở những bệnh nhân được tiêm liên tục hoặc truyền liên tục LA, hoặc những người mắc bệnh tim hoặc thận cùng tồn tại, nên giảm liều [26].
5.3. Kỹ thuật
Dữ liệu từ các cơ quan đăng ký lớn và báo cáo trường hợp được công bố cho thấy rằng rủi ro của LAST khác nhau giữa các loại blocks. Vasques et al và Gitman và Barrington đã tóm tắt dữ liệu báo cáo trường hợp được công bố từ năm 2010 đến 2014 và giữa năm 2014 và 2016, tương ứng, xác định tổng cộng 125 trường hợp [26, 27]. Là một nhóm, các kỹ thuật xâm nhập LA thường liên quan nhất, chiếm 20% các kết quả. Điều này được theo sau bởi các blocks thần kinh trung ương (ngoài màng cứng và đám rối cùng) trong 15% và truyền LA liên tục trong 13% các kết quả. Các yếu tố có thể có ảnh hưởng đến những kết quả này bao gồm liều LA thường được sử dụng và mạch máu của vùng liên quan. Một tỷ lệ đáng chú ý của các kết quả (18%) xảy ra sau các blocks dương vật ở trẻ em và có khả năng là kết quả của sự hợp lưu của các yếu tố bao gồm lứa tuổi bệnh nhân dễ mắc bệnh hơn, tiêm vào vùng có mạch máu cao và sử dụng liều gần tối đa giới hạn đề nghị [37].
Trong một phân tích>25.000 blocks dây thần kinh ngoại biên từ cơ sở dữ liệu của Cơ quan gây mê khu vực Úc và New Zealand, nguy cơ tính toán của LAST với các blocks chi dưới (không có sự kiện nào được báo cáo) thấp hơn đáng kể so với các blocks chi trên, lần lượt thấp hơn so với blocks cạnh cột sống [38]. Điều này một lần nữa có thể phản ánh mạch máu tương đối của các vị trí tiêm và nồng độ LA tương ứng trong huyết tương do một liều nhất định [39].
5.3.1. Gây tê mặt phẳng mạc
Gây tê mặt phẳng mạc đã trở nên ngày càng phổ biến trong những năm gần đây như là một phương pháp gây tê vùng thân. Hầu hết các nghiên cứu liên quan đến mặt phẳng mạc ngang bụng (TAP), nhưng tất cả chúng đều có chung đặc điểm chung là tiêm LA thể tích lớn (> 20 mL) vào mặt phẳng mạc gian cơ. Vì cơ bắp thường có nguồn cung cấp mạch máu phong phú, có nguy cơ LAST đáng kể từ sự hấp thụ LA toàn thân. Thời gian đạt nồng độ đỉnh trong huyết tương sau một khối TAP trung bình là 30 phút, nhưng có thể dài tới 90 phút ở một số người [40-43]. Điều này cũng có thể thay đổi theo loại và vị trí blocks; ví dụ, blocks vỏ trực tràng đã được chứng minh là có thời gian tập trung cực đại lâu hơn (60 phút) so với bloks TAP [41,42]. Mặc dù hầu hết các nghiên cứu báo cáo rằng nồng độ huyết tương LA tối đa trung bình sau khối TAP với chế độ dùng thuốc thường được sử dụng nằm dưới ngưỡng độc hại thường được chấp nhận, vẫn có những cá nhân tiếp cận hoặc vượt quá mức này [40, 43-45]. Epinephrine làm giảm sự hấp thu toàn thân và nồng độ huyết tương LA tối đa - ngay cả đối với ropivacaine - và do đó phải luôn luôn được thêm vào dung dịch LA nếu có thể [43,45]. Nồng độ và liều LA thấp hơn cũng nên được sử dụng, đặc biệt nếu bỏ sót epinephrine. 46Các hướng dẫn của Hiệp hội Gây mê và Thuốc giảm đau khu vực Hoa Kỳ khuyến cáo thêm rằng việc dùng thuốc nên dựa trên trọng lượng cơ thể gầy [47].
5.3.2. Kỹ thuật đặt ống thông liên tục
Nguy cơ LAST dường như cao hơn khi phong tỏa dây thần kinh ngoại biên liên tục so với các kỹ thuật tiêm một lần [48 ] và điều này có khả năng liên quan đến liều tích lũy LA. Một nghiên cứu của ống thông khối TAP song phương phát hiện ra rằng 10 mL⋅h -1 truyền 0,2% ropivacain, bắt đầu 30 phút sau liều tấn công 100 mg ropivacain mỗi bên, dẫn đến sự gia tăng liên tục trong nồng độ lên đến 48 giờ [49]. Có sự biến thiên liên cá nhân rộng, với một số lượng lớn đối tượng có tổng nồng độ vượt quá ngưỡng độc hại. Tuy nhiên, thật yên tâm khi lưu ý rằng nồng độ ropivacaine không liên kết thấp hơn nhiều và vẫn ở dưới ngưỡng độc hại. Điều này có liên quan đến sự gia tăng sau phẫu thuật trong phản ứng giai đoạn cấp tính α 1-acid glycoprotein và gợi ý một mức độ an toàn hợp lý khi truyền liên tục được sử dụng trong bối cảnh lâm sàng.
5.3.3. Gây tê cục bộ
Gây tê cục bộ cho các thủ tục phẫu thuật thẩm mỹ như hút mỡ liên quan đến việc tiêm một lượng lớn chất lidocaine vào các mô dưới da, thường có thêm epinephrine để tăng thêm sự an toàn. Hướng dẫn hút mỡ phẫu thuật của Hiệp hội phẫu thuật da liễu Hoa Kỳ khuyến cáo liều lượng an toàn tối đa mg⋅kg −1 của lidoocaine là 55 mg⋅kg 1 [62]. Tuy nhiên, một nghiên cứu dược động gần đây khuyến cáo giới hạn thấp hơn 45 mg⋅kg -1 , và 28 mg⋅kg -1 nếu hút mỡ không được thực hiện [63]. Cần lưu ý rằng khuyến nghị này không loại bỏ hoàn toàn rủi ro, nhưng được thiết kế để hạ thấp nó xuống mức chấp nhận được (1: 2.000). Tỷ lệ tử vong đã được báo cáo độc quyền ở những bệnh nhân được gây mê toàn thân, nhưng các đặc điểm lâm sàng có thể ngấm ngầm và có thể xuất hiện muộn. Do đó, học viên phải sẵn sàng nhận ra và điều trị LAST [64].
5.3.4. Gây tê tại chỗ của vòm họng và đường thở
LAST đã được báo cáo sau khi gây tê tại chỗ của hầu họng và đường thở cho một loạt các thủ tục, bao gồm siêu âm tim qua thực quản và nội soi phế quản [65-67]. Các yếu tố có khả năng đóng góp bao gồm nhận thức rằng lidocaine tương đối an toàn, không theo dõi được liều được đưa ra và tăng độ nhạy cảm ở những bệnh nhân mắc bệnh đi kèm đáng kể [68]. Sự hấp thu toàn thân của lodocaine phụ thuộc vào một mức độ nào đó vào chế độ phân phối. Một tỷ lệ đáng kể bị mất trong khí quyển với quá trình phun sương và nguyên tử hóa, hoặc bị nuốt và làm sạch thông qua quá trình trao đổi chất đầu tiên. Kết quả là, bằng chứng sẵn có chỉ ra rằng có thể sử dụng tới 9 mg⋅kg 1 một cách an toàn ở những bệnh nhân khỏe mạnh [69,70].
5.3.5. Gây tê vùng tĩnh mạch
Tiêm tĩnh mạch lidocain đã được sử dụng cho các tình trạng đau cấp tính và mãn tính, với liều khác nhau, từ 1 đến 3 mg⋅kg -1 bolus và 1-5 mg⋅kg -1 ⋅hour -1 truyền liên lục để đạt được nồng độ trong huyết tương điều trị từ2,5- 3,5µg.mL 1 [68,71]. Ngưỡng nồng độ trong huyết tương huyết thanh cho độc tính nhẹ và xuất hiện triệu chứng thần kinh được báo cáo là 6 μg⋅mL -1 , với sự tiến triển đến triệu chứng tim mạch với nồng độ trong huyết tương> 10 μg⋅mL -1 [72], đó là sự phản ánh của tỷ lệ CC / CNS cao. Các dấu hiệu CNS nhẹ được báo cáo ở 11% bệnh nhân, trong khi các dấu hiệu tim mạch phát sinh ở 4% - 15% bệnh nhân, từ nhịp tim chậm đến rung nhĩ. Bệnh nhân nhạy cảm có thể biểu hiện LAST với chế độ dùng thuốc với liều thấp hơn, và lựa chọn bệnh nhân cẩn thận là rất quan trọng trong việc xem xét sử dụng thuốc tiêm lidocaine tiêm tĩnh mạch [73,74].
Gây tê vùng tĩnh mạch (Bier blocks) có liên quan đến nguy cơ biến chứng lớn, với các triệu chứng và dấu hiệu toàn thể của LAST. Co giật đã được báo cáo với liều thấp như 1,4 mg⋅kg -1 của lidocain, 4 mg⋅kg -1 của prilocaine, và 1,3 mg⋅kg -1 của buvivacain, và ngừng tim ở liều thấp nhất là 2,5 mg⋅kg - 1 của lidocaine và 1,6 mg⋅kg −1 bupivacaine [75]. Đáng chú ý, LAST có thể xảy ra ngay cả trong quá trình bị garo và tới 30 phút sau khi xả garo.
5.3.6. Khác
Dữ liệu tích lũy từ các báo cáo trường hợp, cơ sở dữ liệu và chuỗi trường hợp đã nêu bật một số yếu tố rủi ro khác cho sự phát triển của LAST. Đáng chú ý, một phần năm các trường hợp LAST xảy ra bên ngoài các cơ sở bệnh viện truyền thống, và một nửa số LAST xảy ra trong tay của những người không phải chuyên gia gây mê.
6. Phòng ngừa
Phòng ngừa phải là ưu tiên hàng đầu để giảm tần suất và mức độ nghiêm trọng của LAST[47]. Không có sự can thiệp nào giúp loại bỏ rủi ro và do đó, phòng ngừa là một quá trình đa yếu tố.
6.1. Blocks dây thần kinh hướng dẫn siêu âm
Siêu âm đã được chứng minh là làm giảm 60% nguy cơ LAST so với kích thích thần kinh ngoại biên đơn thuần [38,53,76]. Có nhiều cách giải thích cho việc giảm rủi ro này. Tăng độ chính xác của sự phân phối cho phép giảm về thể tích và do đó, giảm liều LA; tỷ lệ thủng mạch máu có thể giảm; và tín hiệu thị giác báo hiệu tiêm nội mạch cho phép chấm dứt tiêm trước khi đưa ra một liều đáng kể. Tuy nhiên, các sự kiện LAST vẫn tiếp tục xảy ra mặc dù sử dụng siêu âm và hướng dẫn siêu âm không ảnh hưởng đến nguy cơ LAST do hấp thu LA toàn thân [38].
6.2. Thuốc và cách tiêm
Hạn chế liều lượng thuốc có thể góp phần giảm rủi ro LAST. Nên thực hiện tiêm LA phân đoạn trong khoảng <5 mL, tạm dừng trong 30- 45 giây giữa các lần tiêm, 26 với hút nhẹ trước khi tiêm. Biện pháp sau này vẫn hữu ích mặc dù tỷ lệ âm tính giả khoảng 2% [47]. Các chất dấu hiệu như epinephrine cũng có thể giảm thiểu nguy cơ tiêm nội mạch, khi bổ sung 15 µg⋅mL−1 sẽ làm tăng nhịp tim thêm ≥10 nhịp mỗi phút hoặc huyết áp tâm thu ≥15 mmHg. Các can thiệp thực tế như ghi nhãn rõ ràng các ống tiêm có chứa LA và xử lý tỉ mỉ các ống tiêm này có thể có ích. Việc chuyển đổi từ các đầu nối Luer sang các đầu nối nhỏ tiêu chuẩn ISO 80369 mới cũng có thể làm giảm nguy cơ tiêm sai tuyến [77,78].
7. Điều trị
7.1. Chuẩn bị
Tất cả các bệnh nhân được tiêm LA với liều đủ để gây LAST nên được thở oxy, theo dõi tiêu chuẩn và áp dụng đường truyền tĩnh mạch. Việc theo dõi nên tiếp tục trong ít nhất 30 phút sau khi hoàn thành tiêm, vì các diễn biến muộn xảy ra ngày càng tăng [27,79]. Nên lập tức truy cập LAST Management Checklist, và tất cả các loại thuốc và thiết bị hồi sức cần có ngay lập tức, tốt nhất là dưới dạng Bộ cứu hộ cứu hộ LAST. Mặc dù dữ liệu cho thấy sự tuân thủ không nhất thiếtphải được tiêu chuẩn hóa, giá trị của các hướng dẫn này không thể được đánh giá thấp.
7.2. Quản lý ngay lập tức
Quản lý ngay lập tức liên quan đến các biện pháp an toàn và hồi sức chung là rất cần thiết trong bất kỳ trường hợp khẩn cấp nào. Đầu tiên, ngừng tiêm LA và gọi trợ giúp. Ưu tiên trước mắt là quản lý đường thở, hô hấp và tuần hoàn.
7.3. Duy trì đường thở, oxy hóa và thông khí
Quản lý đường thở nhanh chóng và hiệu quả là rất quan trọng để ngăn ngừa tình trạng thiếu oxy, chứng tăng huyết áp và nhiễm toan (chuyển hóa hoặc hô hấp), được biết là có tác dụng tăng cường LAST. Đường thở phải được bảo đảm và sử dụng oxy 100%, lưu ý rằng tăng thông khí và nhiễm kiềm hô hấp cũng đã được chứng minh là gây tổn thương [80].
7.4. Liệu pháp nhũ tương lipid tiêm tĩnh mạch
Những tiến bộ gần đây trong sự hiểu biết về các cơ chế hoạt động của nhũ tương lipid nhấn mạnh tầm quan trọng của phương thức trị liệu này trong việc quản lý LAST. Dữ liệu cho thấy nhũ tương lipid có thể đưa bất kỳ tác nhân LA nào từ các cơ quan lưu lượng máu cao - chẳng hạn như tim hoặc não - đến các cơ quan lưu trữ hoặc giải độc như cơ bắp hoặc gan [81]. Liệu pháp nhũ tương lipid cũng có thể cải thiện cung lượng tim và huyết áp (do đó tạo điều kiện thuận lợi hơn cho hiệu ứng vận chuyển), trong khi bảo vệ cơ tim sau điều hòa cũng có thể xảy ra [82-85]. Có rất ít dữ liệu chất lượng cao, quy mô lớn chứng minh hiệu quả lâm sàng của liệu pháp nhũ tương lipid, chủ yếu do những khó khăn trong việc thu thập dữ liệu hợp lệ và tính khả thi hạn chế của các nghiên cứu tiền cứu [86,87]. Tuy nhiên, các nghiên cứu trên động vật chứng minh sự hỗ trợ mạnh mẽ cho việc sử dụng liệu pháp nhũ tương lipid trong việc giảm tỷ lệ tử vong khi áp dụng kết hợp với các biện pháp can thiệp hồi sức [88].
Do đó, việc sử dụng sớm 20% liệu pháp nhũ tương lipid tiêm tĩnh mạch nên được ưu tiên ngay lập tức sau khi điều trị đường thở trong bất kỳ sự kiện LAST nào được đánh giá là có khả năng nghiêm trọng. Sự hội tụ của các nhà quản trị khác nhau giữa Hiệp hội Gây mê và Thuốc giảm đau khu vực Hoa Kỳ và Hiệp hội Bác sĩ gây mê của Vương quốc Anh và Ireland đã dẫn đến sự thống nhất trong các phác đồ điều trị [47,89]. Nên dùng một liều bolus ban đầu là 100 ml trong hơn 2 phút 3 phút (1,5 ml⋅kg −1 nếu trọng lượng cơ thể gầy <70 kg). Sau đó, sau đó được truyền dịch nhũ tương 20% lipid 200% 250 ml trong 15 - 20 phút (0,25 mL⋅kg −1 ⋅min 1nếu trọng lượng cơ thể gầy <70 kg). Nếu không đạt được sự ổn định tuần hoàn, nên tiêm lại tối đa hai lần nữa hoặc tăng truyền dịch lên 0,5 mL⋅kg −1 ⋅min 1 . Liều khuyến cáo tối đa của nhũ tương lipid 20% là 12 mL⋅kg −1 .
7.5. Quản lý động kinh
Hoạt động co giật có thể làm trầm trọng thêm nhiễm toan chuyển hóa, và phòng ngừa và chấm dứt kịp thời là rất quan trọng. Do hồ sơ tim mạch của họ, các thuốc benzodiazepin là liệu pháp đầu tiên. Nên tránh sử dụng propofol khi có dấu hiệu tổn thương tim mạch, xét về tác dụng của liều lớn đối với chức năng tim bị suy nhược, nhưng có thể sử dụng liều nhỏ. Nếu cơn co giật kéo dài bất chấp mọi nỗ lực, giãn cơ liều thấp có thể được xem xét để giảm nhiễm toan chuyển hóa và thiếu oxy do co thắt cơ bắp đang diễn ra.
7.6. Hỗ trợ tim mạch
Các kỹ thuật hỗ trợ cuộc sống tim nâng cao cho hồi sức tim phổi phải được tuân thủ nếu xảy ra ngừng tim. Ép ngực nên được bắt đầu ngay lập tức và tiếp tục cho đến khi trở lại lưu thông tự phát. Nếu sử dụng epinephrine, liều ban đầu nhỏ ≤1 µg⋅kg−1 được ưu tiên để tránh trao đổi khí ở phổi bị suy yếu và tăng hậu quả [90]. Vasopressin không được khuyến cáo sử dụng vì nó có liên quan đến kết quả bất lợi trong mô hình động vật. Trong trường hợp không phục hồi nhanh chóng sau các biện pháp hỗ trợ cuộc sống nâng cao và liệu pháp nhũ tương lipid tiêm tĩnh mạch, nên xem xét sớm tuần hoàn ngoài cơ thể hỗ trợ.
Hiệu quả ảnh hưởng đến sự co bóp cơ tim của liệu pháp nhũ tương lipid chỉ xảy ra khi nồng độ LA cơ tim dưới ngưỡng tương ứng với nồng độ chặn kênh ion. Điều này nhấn mạnh tầm quan trọng của việc ép ngực hiệu quả để đảm bảo tưới máu mạch vành đủ để giảm mức mô LA để đạt được lợi ích của liệu pháp nhũ tương lipid.
Nếu cung lượng tim được duy trì nhưng có các hiệu ứng CVS nguy hiểm - như rối loạn nhịp tim, blocks dẫn truyền, hạ huyết áp tiến triển và nhịp tim chậm - các thuật toán hỗ trợ nhịp tim nâng cao tiêu chuẩn nên được tuân theo khi bỏ qua LA, như điều trị rối loạn nhịp tim. Amiodarone là thuốc chống loạn nhịp đầu tiên trong trường hợp rối loạn nhịp thất.
7.7. Quản lý sau sự kiện
Sau xử trí LAST với các triệu chứng CVS, bệnh nhân nên được theo dõi ít nhất 6 giờ, trong khi các triệu chứng CNS bị đơn độc và chấm dứt nhanh chóng yêu cầu theo dõi bệnh nhân trong tối thiểu 2 giờ. Khuyến khích rằng các trường hợp nên được báo cáo đến cơ quan đăng ký tại www.lipidresTHER.org [91].
8. Kết luận
LAST là một tác dụng phụ đe dọa tính mạng và những tiến bộ gần đây trong việc tìm hiểu cơ sở sinh lý bệnh của tình trạng này và liệu pháp của nó sẽ cải thiện sự an toàn của bệnh nhân. Điều bắt buộc là các nhà lâm sàng sử dụng LA trong thực hành lâm sàng của họ là nhận thức về các cơ chế, yếu tố nguy cơ, phòng ngừa và phương thức điều trị.
Tài liệu tham khảo
1. El-Boghdadly K, Pawa A. The erector spinae plane block: plane and simple. Anaesthesia. 2017;72(4):434–438. [PubMed] [Google Scholar]
2. Forero M, Adhikary SD, Lopez H, Tsui C, Chin KJ. The Erector Spinae Plane Block. Reg Anesth Pain Med. 2016;41(5):621–627. [PubMed] [Google Scholar]
3. Ilfeld BM. Continuous peripheral nerve blocks: a review of the published evidence. Anesth Analg. 2011;113(4):904–925. [PubMed] [Google Scholar]
4. Pawa A, Wight J, Onwochei DN, et al. Combined thoracic paravertebral and pectoral nerve blocks for breast surgery under sedation: a prospective observational case series. Anaesthesia. 2018;73(4):438–443.[PubMed] [Google Scholar]
5. Conroy PH, O’Rourke J. Tumescent anaesthesia. Surgeon. 2013;11(4):210–221. [PubMed] [Google Scholar]
6. Dillane D, Finucane BT. Local anesthetic systemic toxicity. Can J Anesth Can D’anesthésie. 2010;57(4):368–380. [PubMed] [Google Scholar]
7. Butterworth JF. Models and mechanisms of local anesthetic cardiac toxicity: a review. Reg Anesth Pain Med. 2010;35(2):167–176. [PubMed] [Google Scholar]
8. Tucker GT. Pharmacokinetics of local anaesthetics. Br J Anaesth. 1986;58(7):717–731. [PubMed] [Google Scholar]
9. Becker DE, Reed KL. Local anesthetics: review of pharmacological considerations. Anesth Prog. 2012;59(2):90–102. [PMC free article] [PubMed] [Google Scholar]
10. Butterworth JF, Strichartz GR. Molecular mechanisms of local anesthesia: a review. Anesthesiology. 1990;72(4):711–734. [PubMed] [Google Scholar]
11. Groban L, Dolinski SY. Differences in cardiac toxicity among ropivacaine, levobupivacaine, bupivacaine, and lidocaine. Techniques in Regional Anesthesia and Pain Management. 2001;5(2):48–55.[Google Scholar]
12. Komai H, Mcdowell TS. Local anesthetic inhibition of voltage-activated potassium currents in rat dorsal root ganglion neurons. Anesthesiology. 2001;94(6):1089–1095. [PubMed] [Google Scholar]
13. Valenzuela C, Delpón E, Tamkun MM, Tamargo J, Snyders DJ. Stereoselective block of a human cardiac potassium channel (Kv1.5) by bupivacaine enantiomers. Biophys J. 1995;69(2):418–427.[PMC free article] [PubMed] [Google Scholar]
14. Coyle DE, Sperelakis N. Bupivacaine and lidocaine blockade of calcium-mediated slow action potentials in guinea pig ventricular muscle. J Pharmacol Exp Ther. 1987;242(3):1001–1005. [PubMed] [Google Scholar]
15. Clarkson CW, Hondeghem LM. Mechanism for Bupivacaine Depression of Cardiac Conduction. Anesthesiology. 1985;62(4):396–405. [PubMed] [Google Scholar]
16. Fettiplace MR, Kowal K, Ripper R, et al. Insulin Signaling in Bupivacaine-induced Cardiac Toxicity: Sensitization during Recovery and Potentiation by Lipid Emulsion. Anesthesiology. 2016;124(2):428–442.[PMC free article] [PubMed] [Google Scholar]
17. Piegeler T, Votta-Velis EG, Bakhshi FR, et al. Endothelial barrier protection by local anesthetics: ropivacaine and lidocaine block tumor necrosis factor-a-induced endothelial cell Src activation. Anesthesiology. 2014;120(6):1414–1428. [PMC free article] [PubMed] [Google Scholar]
18. Piegeler T, Votta-Velis EG, Liu G, et al. Antimetastatic potential of amide-linked local anesthetics: inhibition of lung adenocarcinoma cell migration and inflammatory Src signaling independent of sodium channel blockade. Anesthesiology. 2012;117(3):548–559. [PMC free article] [PubMed] [Google Scholar]
19. Butterworth JF, 4th, Brownlow RC, Leith JP, Prielipp RC, Cole LR. Bupivacaine inhibits cyclic-3′,5′-adenosine monophosphate production. A possible contributing factor to cardiovascular toxicity. Anesthesiology. 1993;79(1):88–95. [PubMed] [Google Scholar]
20. Pişkin Ö, Aydın BG, Pişkin ABG.Effects of insulin+glucose pretreatment on bupivacaine cardiotoxicity in rats. Hum Exp Toxicol. 2018;37(5):451–457. [PubMed] [Google Scholar]
21. Roth D, Pace NL, Lee A, et al. Airway physical examination tests for detection of difficult airway management in apparently normal adult patients. Cochrane Database Syst Rev. 2018;5(5):CD008874.[PMC free article] [PubMed] [Google Scholar]
22. Schultze SM, Hemmings BA, Niessen M, Tschopp O. PI3K/AKT, MAPK and AMPK signalling: protein kinases in glucose homeostasis. Expert Rev Mol Med. 2012;14:e1. [PubMed] [Google Scholar]
23. Zink W, Graf BM. The toxicity of local anesthetics: the place of ropivacaine and levobupivacaine. Curr Opin Anaesthesiol. 2008;21(5):645–650. [PubMed] [Google Scholar]
24. Watanabe Y, Dohi S, Iida H, Ishiyama T. The effects of bupivacaine and ropivacaine on baroreflex sensitivity with or without respiratory acidosis and alkalosis in rats. Anesth Analg. 1997;84(2):398–404.[PubMed] [Google Scholar]
25. Neal JM, Bernards CM, Butterworth JF, et al. ASRA practice advisory on local anesthetic systemic toxicity. Reg Anesth Pain Med. 2010;35(2):152–161. [PubMed] [Google Scholar]
26. El-Boghdadly K, Chin KJ. Local anesthetic systemic toxicity: Continuing Professional Development. Can J Anaesth. 2016;63(3):330–349. [PubMed] [Google Scholar]
27. Gitman M, Barrington MJ. Local Anesthetic Systemic Toxicity: A Review of Recent Case Reports and Registries. Reg Anesth Pain Med. 2018;43(2):124–130. [PubMed] [Google Scholar]
28. di Gregorio G, Neal JM, Rosenquist RW, Weinberg GL. Clinical presentation of local anesthetic systemic toxicity: a review of published cases, 1979 to 2009. Reg Anesth Pain Med. 2010;35(2):181–187.[PubMed] [Google Scholar]
29. Mulroy MF. Systemic toxicity and cardiotoxicity from local anesthetics: incidence and preventive measures. Reg Anesth Pain Med. 2002;27(6):556–561. [PubMed] [Google Scholar]
30. Groban L. Central nervous system and cardiac effects from long-acting amide local anesthetic toxicity in the intact animal model. Reg Anesth Pain Med. 2003;28(1):3–11. [PubMed] [Google Scholar]
31. Breslin DS, Martin G, Macleod DB, D’Ercole F, Grant SA. Central nervous system toxicity following the administration of levobupivacaine for lumbar plexus block: A report of two cases. Reg Anesth Pain Med. 2003;28(2):144–147. [PubMed] [Google Scholar]
32. Weiss E, Jolly C, Dumoulin JL, et al. Convulsions in 2 patients after bilateral ultrasound-guided transversus abdominis plane blocks for cesarean analgesia. Reg Anesth Pain Med. 2014;39(3):248–251.[PubMed] [Google Scholar]
33. Rosenberg PH, Veering BT, Urmey WF. Maximum recommended doses of local anesthetics: a multifactorial concept. Reg Anesth Pain Med. 2004;29(6):564–575. [PubMed] [Google Scholar]
34. Pere PJ, Ekstrand A, Salonen M, et al. Pharmacokinetics of ropivacaine in patients with chronic renal failure. Br J Anaesth. 2011;106(4):512–521. [PubMed] [Google Scholar]
35. Pere P, Salonen M, Jokinen M, Rosenberg PH, Neuvonen PJ, Haasio J. Pharmacokinetics of ropivacaine in uremic and nonuremic patients after axillary brachial plexus block. Anesth Analg. 2003;96(2):563–569. [PubMed] [Google Scholar]
36. Vasques F, Behr AU, Weinberg G, Ori C, di Gregorio G. A Review of Local Anesthetic Systemic Toxicity Cases Since Publication of the American Society of Regional Anesthesia Recommendations. Reg Anesth Pain Med. 2015;40(6):1–705. [PubMed] [Google Scholar]
37. Yu RN, Houck CS, Casta A, Blum RH. Institutional Policy Changes to Prevent Cardiac Toxicity Associated With Bupivacaine Penile Blockade in Infants. Case Rep. 2016;7(3):71–75. [PubMed] [Google Scholar]
38. Barrington MJ, Kluger R. Ultrasound guidance reduces the risk of local anesthetic systemic toxicity following peripheral nerve blockade. Reg Anesth Pain Med. 2013;38(4):289–297. [PubMed] [Google Scholar]
39. Tucker GT, Moore DC, Bridenbaugh PO, Bridenbaugh LD, Thompson GE. Systemic absorption of mepivacaine in commonly used regional block procedures. Anesthesiology. 1972;37(3):277–287.[PubMed] [Google Scholar]
40. Trabelsi B, Charfi R, Bennasr L, et al. Pharmacokinetics of bupivacaine after bilateral ultrasound-guided transversus abdominis plane block following cesarean delivery under spinal anesthesia. Int J Obstet Anesth. 2017;32:17–20. [PubMed] [Google Scholar]
41. Murouchi T, Iwasaki S, Yamakage M. Chronological Changes in Ropivacaine Concentration and Analgesic Effects Between Transversus Abdominis Plane Block and Rectus Sheath Block. Reg Anesth Pain Med. 2015;40(5):568–571. [PubMed] [Google Scholar]
42. Yasumura R, Kobayashi Y, Ochiai R. A comparison of plasma levobupivacaine concentrations following transversus abdominis plane block and rectus sheath block. Anaesthesia. 2016;71(5):544–549.[PubMed] [Google Scholar]
43. Toju K, Shiraishi K, Hakozaki T, Isosu T, Murakawa M. Plasma ropivacaine concentration following ultrasound-guided subcostal transversus abdominis plane block in adults. J Anesth. 2015;29(1):146–148.[PubMed] [Google Scholar]
44. Bardsley H, Gristwood R, Baker H, Watson N, Nimmo W. A comparison of the cardiovascular effects of levobupivacaine and rac-bupivacaine following intravenous administration to healthy volunteers. Br J Clin Pharmacol. 1998;46(3):245–249. [PMC free article] [PubMed] [Google Scholar]
45. Corvetto MA, Echevarría GC, De La Fuente N, Mosqueira L, Solari S, Altermatt FR. Comparison of plasma concentrations of levobupivacaine with and without epinephrine for transversus abdominis plane block. Reg Anesth Pain Med. 2012;37(6):633–637. [PubMed] [Google Scholar]
46. Miranda P, Corvetto MA, Altermatt FR, Araneda A, Echevarría GC, Cortínez LI. Levobupivacaine absorption pharmacokinetics with and without epinephrine during TAP block: analysis of doses based on the associated risk of local anaesthetic toxicity. Eur J Clin Pharmacol. 2016;72(10):1221–1227. [PubMed] [Google Scholar]
47. Neal JM, Barrington MJ, Fettiplace MR, et al. The Third American Society of Regional Anesthesia and Pain Medicine Practice Advisory on Local Anesthetic Systemic Toxicity: Executive Summary 2017. Reg Anesth Pain Med. 2018;43(2):113–123. [PubMed] [Google Scholar]
48. Gurnaney H, Kraemer FW, Maxwell L, Muhly WT, Schleelein L, Ganesh A. Ambulatory continuous peripheral nerve blocks in children and adolescents: a longitudinal 8-year single center study. Anesth Analg. 2014;118(3):621–627. [PubMed] [Google Scholar]
49. Kumar SK, Rao V, Morris RG, Watts RW, Westley IS, Ropivacaine WIS. Ropivacaine (total and unbound) and AGP concentrations after transversus abdominis plane block for analgesia after abdominal surgery. Ther Drug Monit. 2014;36(6):759–764. [PubMed] [Google Scholar]
50. Brydone AS, Souvatzoglou R, Abbas M, Watson DG, Mcdonald DA, Gill AM. Ropivacaine plasma levels following high-dose local infiltration analgesia for total knee arthroplasty. Anaesthesia. 2015;70(7):784–790. [PubMed] [Google Scholar]
51. Fenten MG, Bakker SM, Touw DJ, et al. Pharmacokinetics of 400 mg ropivacaine after periarticular local infiltration analgesia for total knee arthroplasty. Acta Anaesthesiol Scand. 2017;61(3):338–345.[PubMed] [Google Scholar]
52. Affas F, Eksborg S, Wretenberg P, Olofsson C, Stiller CO. Ropivacaine pharmacokinetics after local infiltration analgesia in hip arthroplasty. Anesth Analg. 2014;119(4):996–999. [PubMed] [Google Scholar]
53. Affas F. Local infiltration analgesia in knee and hip arthroplasty efficacy and safety. Scand J Pain. 2016;13:59–66. [PubMed] [Google Scholar]
54. Fenten MG, Rohrbach A, Wymenga AB, Stienstra R. Systemic local anesthetic toxicity after local infiltration analgesia following a polyethylene tibial insert exchange: a case report. Reg Anesth Pain Med. 2014;39(3):264–265. [PubMed] [Google Scholar]
55. Rubin DS, Matsumoto MM, Weinberg G, Roth S. Local Anesthetic Systemic Toxicity in Total Joint Arthroplasty: Incidence and Risk Factors in the United States From the National Inpatient Sample 1998-2013. Reg Anesth Pain Med. 2018;43(2):131–137. [PMC free article] [PubMed] [Google Scholar]
56. Hu D, Onel E, Singla N, Kramer WG, Hadzic A. Pharmacokinetic profile of liposome bupivacaine injection following a single administration at the surgical site. Clin Drug Investig. 2013;33(2):109–115.[PubMed] [Google Scholar]
57. Rice D, Heil JW, Biernat L. Pharmacokinetic Profile and Tolerability of Liposomal Bupivacaine Following a Repeated Dose via Local Subcutaneous Infiltration in Healthy Volunteers. Clin Drug Investig. 2017;37(3):249–257. [PubMed] [Google Scholar]
58. Joshi GP, Patou G, Kharitonov V. The safety of liposome bupivacaine following various routes of administration in animals. J Pain Res. 2015;8:781–789. [PMC free article] [PubMed] [Google Scholar]
59. Burbridge M, Jaffe RA. Exparel®: A New Local Anesthetic with Special Safety Concerns. Anesth Analg. 2015;121(4):1113–1114. [PubMed] [Google Scholar]
60. Kharitonov V. A review of the compatibility of liposome bupivacaine with other drug products and commonly used implant materials. Post-grad Med. 2014;126(1):129–138. [PubMed] [Google Scholar]
61. Aggarwal N. Local anesthetics systemic toxicity association with exparel (bupivacaine liposome)- a pharmacovigilance evaluation. Expert Opin Drug Saf. 2018;17(6):1–7. [PubMed] [Google Scholar]
62. Svedman KJ, Coldiron B, Coleman WP, et al. ASDS guidelines of care for tumescent liposuction. Dermatol Surg. 2006;32(5):709–716. [PubMed] [Google Scholar]
63. Klein JA, Jeske DR. Estimated Maximal Safe Dosages of Tumescent Lidocaine. Anesth Analg. 2016;122(5):1350–1359. [PMC free article] [PubMed] [Google Scholar]
64. Weinberg G. Local Anesthetic Systemic Toxicity and Liposuction: Looking Back, Looking Forward. Anesth Analg. 2016;122(5):1250–1252. [PubMed] [Google Scholar]
65. Bacon B, Silverton N, Katz M, Heath E, Bull DA, Harig J, Tonna JE. Local Anesthetic Systemic Toxicity Induced Cardiac Arrest After Topicalization for Transesophageal Echocardiography and Subsequent Treatment With Extracorporeal Cardiopulmonary Resuscitation. J Cardiothorac Vasc Anesth. 2018 Jan;31 pii: S1053-0770(18)30048-X. [PMC free article] [PubMed] [Google Scholar]
66. Gaïes E, Jebabli N, Lakhal M, Klouz A, Salouage I, Trabelsi S. Delayed convulsion after lidocaine instillation for bronchoscopy. Rev Mal Respir. 2016;33(5):388–390. [PubMed] [Google Scholar]
67. Wu FL, Razzaghi A, Souney PF. Seizure after lidocaine for bronchoscopy: case report and review of the use of lidocaine in airway anesthesia. Pharmacotherapy. 1993;13(1):72–78. [PubMed] [Google Scholar]
68. Weibel S, Jokinen J, Pace NL, et al. Efficacy and safety of intravenous lidocaine for postoperative analgesia and recovery after surgery: a systematic review with trial sequential analysis. Br J Anaesth. 2016;116(6):770–783. [PubMed] [Google Scholar]
69. Woodruff C, Wieczorek PM, Schricker T, Vinet B, Backman SB. Atomised lidocaine for airway topical anaesthesia in the morbidly obese: 1% compared with 2% Anaesthesia. 2010;65(1):12–17. [PubMed] [Google Scholar]
70. Efthimiou J, Higenbottam T, Holt D, Cochrane GM. Plasma concentrations of lignocaine during fibreoptic bronchoscopy. Thorax. 1982;37(1):68–71. [PMC free article] [PubMed] [Google Scholar]
71. Kandil E, Melikman E, Adinoff B. Lidocaine Infusion: A Promising Therapeutic Approach for Chronic Pain. J Anesth Clin Res. 2017;8(1) [PMC free article] [PubMed] [Google Scholar]
72. Eipe N, Gupta S, Penning J. Intravenous lidocaine for acute pain: an evidence-based clinical update. BJA Educ. 2016;16(9):292–298. [Google Scholar]
73. Wong GK, Joo DT, Mcdonnell C. Lipid resuscitation in a carnitine deficient child following intravascular migration of an epidural catheter. Anaesthesia. 2010;65(2):192–195. [PubMed] [Google Scholar]
74. Haldar R, Dubey M, Rastogi A, Singh PK. Intravenous Lignocaine to Blunt Extubation Responses: A Double-Edged Sword. Am J Ther. 2016;23(2):e646–e648. [PubMed] [Google Scholar]
75. Guay J. Adverse events associated with intravenous regional anesthesia (Bier block): a systematic review of complications. J Clin Anesth. 2009;21(8):585–594. [PubMed] [Google Scholar]
76. Orebaugh SL, Kentor ML, Williams BA. Adverse outcomes associated with nerve stimulator-guided and ultrasound-guided peripheral nerve blocks by supervised trainees: update of a single-site database. Reg Anesth Pain Med. 2012;37(6):577–582. [PMC free article] [PubMed] [Google Scholar]
77. Litman RS, Smith VI, Mainland P. New solutions to reduce wrong route medication errors. Paediatr Anaesth. 2018;28(1):8–12. [PubMed] [Google Scholar]
78. Risk Management Analysis Committee of the French Society for Anesthesia and Critical Care (SFAR), French Society for Clinical Pharmacy (SFPC) Piriou V, Theissen A, Arzalier-Daret S. Preventing medication errors in anesthesia and critical care (abbreviated version) Anaesth Crit Care Pain Med. 2017;36(4):253–258. [PubMed] [Google Scholar]
79. Vasques F, Behr AU, Weinberg G, Ori C, di Gregorio G. A Review of Local Anesthetic Systemic Toxicity Cases Since Publication of the American Society of Regional Anesthesia Recommendations: To Whom It May Concern. Reg Anesth Pain Med. 2015;40(6):698–705. [PubMed] [Google Scholar]
80. Mochizuki T, Sato S. Hypocapnia prolongs bradycardia induced by bupivacaine or levobupivacaine in isolated rat hearts. Can J Anaesth. 2008;55(12):836–846. [PubMed] [Google Scholar]
81. Fettiplace MR, Lis K, Ripper R, et al. Multi-modal contributions to detoxification of acute pharmacotoxicity by a triglyceride micro-emulsion. J Control Release. 2015;198:62–70. [PMC free article][PubMed] [Google Scholar]
82. Rahman S, Li J, Bopassa JC, et al. Phosphorylation of GSK-3β mediates intralipid-induced cardioprotection against ischemia/reperfusion injury. Anesthesiology. 2011;115(2):242–253.[PMC free article] [PubMed] [Google Scholar]
83. Lou P-H, Lucchinetti E, Zhang L, et al. The Mechanism of Intralipid®-Mediated Cardioprotection Complex IV Inhibition by the Active Metabolite, Palmitoylcarnitine, Generates Reactive Oxygen Species and Activates Reperfusion Injury Salvage Kinases. PLoS One. 2014;9(1):e87205. [PMC free article][PubMed] [Google Scholar]
84. Stehr SN, Ziegeler JC, Pexa A, et al. The effects of lipid infusion on myocardial function and bioenergetics in l-bupivacaine toxicity in the isolated rat heart. Anesth Analg. 2007;104(1):186–192.[PubMed] [Google Scholar]
85. Fettiplace MR, Ripper R, Lis K, et al. Rapid cardiotonic effects of lipid emulsion infusion*. Crit Care Med. 2013;41(8):e156–e162. [PubMed] [Google Scholar]
86. Weinberg G. Current evidence supports use of lipid rescue therapy in local anaesthetic systemic toxicity. Acta Anaesthesiol Scand. 2017;61(4):365–368. [PubMed] [Google Scholar]
87. Harvey M, Cave G. Lipid emulsion in local anesthetic toxicity. Curr Opin Anaesthesiol. 2017;30(5):632–638. [PubMed] [Google Scholar]
88. Fettiplace MR, Mccabe DJ. Lipid emulsion improves survival in animal models of local anesthetic toxicity: a meta-analysis. Clin Toxicol. 2017;55(7):617–623. [PubMed] [Google Scholar]
89. Association of Anaesthetists of Great Britain and Ireland AAGBI Safety Guideline: Management of Severe Local Anaesthetic Toxicity. [Accessed July 08, 2018].https://www.aagbi.org/sites/default/files/la_toxicity_2010_0.pdf.
90. Wang QG, Wu C, Xia Y, et al. Epinephrine deteriorates pulmonary gas exchange in a rat model of bupivacaine-induced cardiotoxicity: a threshold dose of epinephrine. Reg Anesth Pain Med. 2017;42(3):342–350. [PubMed] [Google Scholar]
91. LipidRescue™ resuscitation [homepage on the Internet] [Accessed July 08, 2018]. Available from:http://www.lipidrescue.org.
92. Berde CB, Strichartz GR. Local anesthetics. In: Miller RD, editor. Miller’s Anesthesia. eighth. Philadelphia: Elsevier; 2015. p. 1043. [Google Scholar]
93. Dadure C, Sola C, Dalens B, Capdevila X. Regional anesthesia in children. In: Miller RD, editor. Miller’s Anesthesia. eighth. Philadelphia: Elsevier; 2015. p. 2718. [Google Scholar]
94. American Academy of Pediatrics; American Academy of Pediatric Dentistry. Cote CJ, Wilson S, Work Group on Sedation Guidelines for monitoring and management of pediatric patients during and after sedation for diagnostic and therapeutic procedures: an update. Pediatrics. 2006;118:2587–2602. [PubMed] [Google Scholar]
Tác giả: Kariem El-Boghdadly, Amit Pawa và Ki Jinn Chin
Nguồn: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6087022/
Tác giả: Biên dịch: Bs. Trần Ngọc Trịnh - Khoa PTGMHS
Ý kiến bạn đọc
Những tin mới hơn
Những tin cũ hơn
-
 Tọa đàm ngày Quốc tế phụ nữ 8.3.2019
Tọa đàm ngày Quốc tế phụ nữ 8.3.2019
-
 Thành lập đơn vị đột quỵ - thầy thuốc ưu tú
Thành lập đơn vị đột quỵ - thầy thuốc ưu tú
thành lập đơn vị đột quỵ - thầy thuốc ưu tú
-
 Ngày thầy thuốc Việt Nam 27.2.2018
Ngày thầy thuốc Việt Nam 27.2.2018
ngày thầy thuốc Việt Nam 27.2.2018
-
 Hội thi quy tắc ứng xử 2018
Hội thi quy tắc ứng xử 2018
hội thi quy tắc ứng xử 2018
-
 Hội nghị khoa học tiết niệu 12.4.2019
Hội nghị khoa học tiết niệu 12.4.2019